Brasil
Anvisa nega certificado de boa prática para Bharat Biotech, que produz a Covaxin

A Agência Nacional de Vigilância Sanitária (Anvisa) indeferiu o pedido de Certificação de Boas Práticas de Fabricação de Medicamentos da Bharat Biotech, fabricante da Covaxin, vacina contra a Covid-19.
Essa etapa é pré-requisito para que os fabricantes de medicamento recebam autorização para o uso emergencial do imunizante ou o registro definitivo. A inspeção na fábrica indiana foi realizada pela agência brasileira no começo de março.
O Ministério da Saúde protocolou na Anvisa, na segunda-feira (22), a solicitação de autorização para importar 20 milhões de doses da Covaxin da Índia, onde o imunizante possui autorização para uso emergencial.
A decisão da agência, assinada pela gerente-geral de Inspeção e Fiscalização Sanitária, Ana Carolina Moreira Marino Araújo, foi publicada na edição desta terça-feira (30) do Diário Oficial da União.
“Considerando o descumprimento dos requisitos de Boas Práticas de Fabricação de Medicamentos, ou o descumprimento dos procedimentos de petições submetidas à análise, preconizados em legislação vigente, resolve: Art. 1º Indeferir o(s) Pedido(s) de Certificação de Boas Práticas de Fabricação de Medicamentos da(s) empresa(s) constante(s) no ANEXO”, diz a resolução.
O pedido de certificação foi feito pela empresa brasileira Precisa – Comercialização de Medicamentos Ltda para a fábrica da Bharat no estado de Telangana, na Índia.
Na justificativa apresentada pela Anvisa foram apresentados o descumprimento de três artigos da Resolução da Diretoria Colegiada (RDC) 69/2014 da agência, que dizem respeito aos documentos que devem ser apresentados no processo, às especificações que devem ser estabelecidas para intermediários e insumos farmacêuticos ativos e à validação dos métodos farmacopeicos usados pela empresa.
Também foram descumpridos cinco artigos da Instrução Normativa (IN) 36/2019 da Anvisa, que tratam de parâmetros operacionais críticos de processo que afetam a qualidade do produto, de métodos utilizados para esterilização, de medidas devem ser adotadas para se evitar o risco de uma nova contaminação de produtos, de processo para assegurar a completa inativação do organismo vivo, entre outros problemas.
A decisão da agência cita também a violação de três artigos previstos na IN 35/2019: o 108, o 154 e o 158. Eles versam sobre o monitoramento da biocarga, sobre o tempo requerido para se filtrar um volume conhecido da solução a granel e determinam que o filtro não deve afetar o produto.
Por fim, também foi incluído na resolução o descumprimento do artigo 94 da IN 47/2019, que determina que “todos os métodos analíticos, utilizados na qualificação, validação ou limpeza, devem ser validados com os limites de detecção e quantificação adequados”.
Fonte: CNN Brasil
-

 Iguatu1 semana atrás
Iguatu1 semana atrásDeputado Marcos Sobreira vota contra emenda para tratamento oncológico em Iguatu e decisão gera forte reação
-

 Brasil1 semana atrás
Brasil1 semana atrásTrabalhadores processam Volkswagen por regime análogo à escravidão; Ministério aponta incentivos da ditadura
-

 Iguatu2 semanas atrás
Iguatu2 semanas atrásIGUATU – PRESIDENTE DO CONSELHO MUNICIPAL DE EDUCAÇÃO É DEMITIDO APÓS CONDENAÇÃO POR FALSIFICAÇÃO DE DOCUMENTOS
-

 Iguatu1 semana atrás
Iguatu1 semana atrásEnquanto o Governo do Ceará amplia o Sinalize, Iguatu arrecada milhões em IPVA e mantém ruas esburacadas
-

 Ceará1 semana atrás
Ceará1 semana atrás‘Até que a morte os separe’: em 80% dos feminicídios o autor é o companheiro ou ex da vítima
-
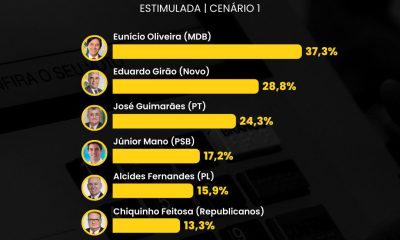
 Ceará1 semana atrás
Ceará1 semana atrásPesquisa do Instituto Paraná Pesquisas aponta Eunício Oliveira na liderança para o Senado no Ceará
-

 Iguatu2 semanas atrás
Iguatu2 semanas atrásJustiça proíbe rádio de Iguatu (CE) de tocar músicas e cobra R$ 971 mil em ação por não pagamento de direitos autorais
-
 Ceará1 semana atrás
Ceará1 semana atrásMaranguape terá vacinação acelerada com nova vacina contra a dengue, anuncia Ministério da Saúde


